임상시험계획 승인신청(IND, Investigational New Drug Application)
전임상 시험 완료 후, 인체를 대상으로 임상시험을 실시하기 위해 사전승인을 받는 절차
품목(신약)허가신청(NDA/BLA, New Drug Application/Biologics License Application)
임상시험 이후, 의약품의 판매승인을 얻기 위한 허가신청절차
- 합성의약품→ NDA
- 단백질 제제, 유전자치료제, 세포치료제, 혈액 제제 등의 생물학적 제제 의약품→ BLA
- 제네릭 의약품에 대한 NDA→ ANDA(Abbreviated New Drug Application)
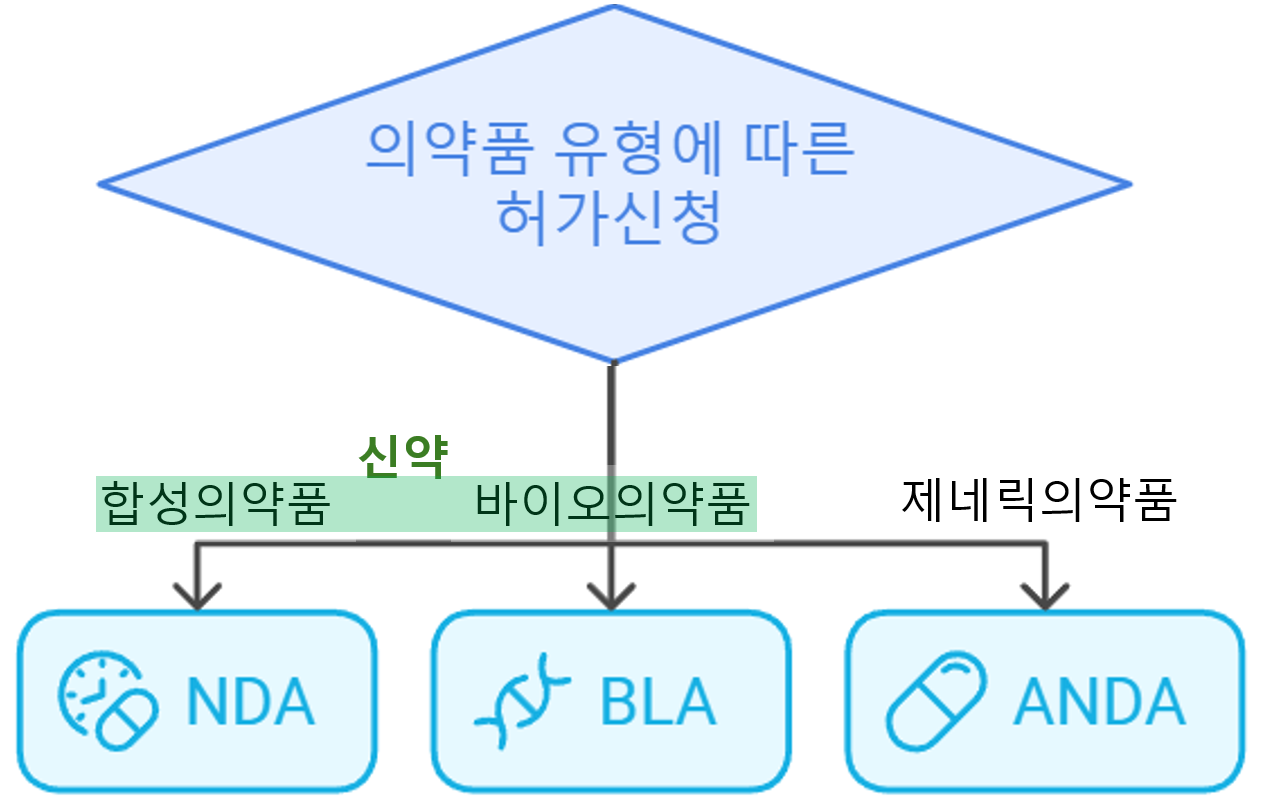
1. 목적
임상시험 승인신청 (IND) 후보물질을 안전하게 임상시험에서 테스트할 수 있는지
- 신약 후보물질이 사람을 대상으로 한 임상시험을 시작할 수 있도록 FDA로부터 승인받는 것
- 임상시험 중 환자의 안전을 보장하고, 윤리적이고 과학적인 임상시험 수행 보장
신약허가신청 (NDA/BLA) 후보물질이 안전하고, 효과적이며, 품질이 보장되는지 (안정성 및 유효성 입증)
- 임상시험 결과를 바탕으로 신약을 시판할 수 있도록 FDA로부터 허가를 받는 것
- 환자에게 약물이 안전하고 효과적인지 및 품질이 일관되고 규제 요구사항을 충족하는지 확인.
2. 제출 시점
IND
- 전임상 시험(in vitro 및 in vivo 연구)을 완료한 후, 임상시험(Phase 1, 2, 3)을 시작하기 전
NDA/BLA
- 임상시험 (Phase 1, 2, 3)이 모두 완료된 후
3. 포함되는 주요 데이터
IND
- 전임상 데이터: 독성 시험 결과(동물 실험), 약리학적 데이터(효능 및 작용 기전).
- 임상시험 계획서: 시험 설계(Phase 1, 2, 3), 시험 대상자 모집 계획 및 윤리적 고려사항.
- 제조 및 품질 정보: 시험 약물의 제조 방법 및 품질 관리.
NDA/BLA
- 임상 데이터: Phase 1, 2, 3의 안전성 및 유효성 데이터, 통계 분석 결과.
- CMC 데이터: 약물의 화학적 구성, 제조 공정, 품질 관리. 안정성 시험 결과.
- 약물 라벨링 초안: 사용법, 부작용, 경고 사항, 사용 금기.
- 시판 후 계획: 부작용 모니터링 계획 (Risk Management Plan).
4. 검토 및 승인 절차
IND
- FDA는 30일 내에 신청서를 검토하고 승인 여부 결정.
- 일부 경우에는 보완 요청 또는 보류(Clinical Hold) 결정이 내려질 수 있음.
NDA/BLA
- FDA는 10개월 동안 신청서를 검토 (우선 심사는 6개월).
- 검토 후 승인, 보완 요청(Complete Response Letter), 또는 거부 결정.
5. 결과
IND
- 임상시험을 시작할 수 있는 승인 → 환자 모집 및 시험 실행 가능.
NDA/BLA
- 신약의 시판 허가 → 제품 라벨링 확정 및 상업적 판매 가능.
| 항목 | 임상시험 승인신청(IND) | 신약허가신청 (NDA/BLA) |
| 목적 | 임상시험 시작 승인 | 신약 시판 허가 |
| 신청 시기 | 전임상 시험 완료 후 | 임상시험 완료 후 |
| 주요 데이터 | 전임상 데이터, 임상시험 계획서, 시험 약물의 제조 및 품질 정보 | 임상 데이터, CMC 데이터(약물의 제조공정 및 품질 관리, 안정성 시험 결과), 라벨링 초안, 시판 후 계획 |
| 검토 기간 | 30일 | 10개월 (우선심사: 6개월) |
| 승인 결과 | 임상시험 시작 (환자 모집 및 시험 실행 가능) | 신약 시판 가능 |
(관련 주제)
신약개발단계별, 구조 및 효과 공개 시점을 고려한 특허전략 수립